 发病机制
发病机制
发病机制:目前有相当多的证据支持韦格纳肉芽肿病是一个自身免疫性疾病,ANCA可能参与了血管的激活和损伤。如WG与抗PR3的自身抗体有强的特异关系,抗体效价与临床疾病活动性相关,并可预示复发。疾病对免疫抑制剂治疗反应良好。但也有不支持的依据。尽管在大部分WG病人血清中可检测到抗PR3的特异抗体,但仍有少部分病人ANCA阴性。其次,在受累组织中,既没有发现自身抗体,也没有自身反应性T细胞,没有发现抗PR3的免疫复合物。因此,提示即使ANCA在WG的致病中有一定作用,也不是最基本的作用。
1.ANCA致病机制
(1)ANCA与多形核粒细胞(PMN)之间的反应:PMN在被ANCA激活前需其他炎前因子的启动(primed),在细胞表面表达很多胞浆抗原,包括PR3和MPO,使细胞获得与自身抗体相互作用的靶抗原。已启动的PMN在与ANCA相互作用后,是如何被激活的仍有争论。Kettritz认为细胞表面表达的PR3和MPO之间的交联是激活的基础,因为ANCA的F(ab’)2片段能激活已启动的PMN,而Fab片段则不能。其他作者未能证实上述发现,但发现通过抗体与Fc受体相互作用也可激活PMN,FcγRⅡa和FcγⅢRb均参与了这个过程。另外,针对β2整合素,特别是CD18的封闭抗体能抑制ANCA诱导的PMN激活。
激活的PMN可产生毒性氧基,脱颗粒释放溶酶体酶。另外,它们也可分泌炎症介质如TNFα,IL-1,IL-8和LTB4。激活的PMN黏附分子表达增加,这使PMN易于结合并穿透内皮细胞层。WG病人肾活检标本显示肾小球出现激活的PMN,且激活的PMN数目与肾功能损害的程度相关。此外,激活的PMN也出现于血液循环中,激活的程度与疾病的活动性相关。
(2)ANCA与单核细胞之间的相互作用:ANCA能激活单核细胞,使其毒性氧基,IL-8和MIP-1产生增加。激活前不需要启动,但启动能提高ANCA介导的毒性氧基的产生。
(3)ANCA与内皮细胞之间的关系:内皮细胞是否表达ANCA的靶抗原(特别是PR3)仍有争论。内皮细胞在炎前因子的刺激下,PR3表达增加,并从胞质转位到细胞膜上,使PR3能与ANCA相互作用。PR3-ANCA能诱导内皮细胞黏附分子的上调和IL-1、组织因子的表达。内皮细胞与PR3-ANCA孵育时,内皮细胞合成前列环素、PAF、IL-8增加,蛋白渗漏增加,内皮细胞凋亡、脱落和溶解。
(4)综上所述,参与ANCA相关血管炎的机制如下:
①由于局部感染而释放的细胞因子引起内皮细胞黏附分子的上调,并启动中性粒细胞和(或)单核细胞。
②循环中已启动的中性粒细胞和(或)单核细胞在其细胞表面表达ANCA抗原。
③已启动的中性粒细胞和(或)单核细胞黏附于内皮细胞,随后被ANCA激活。激活的中性粒细胞和(或)单核细胞释放毒性氧基和溶酶体酶,它们导致内皮细胞损伤,最终到坏死性炎症。
④ANCA激活的中性粒细胞和(或)单核细胞脱颗粒释放蛋白酶3和髓过氧化物酶,PR3和MPO使内皮细胞激活、损伤甚至凋亡。其次,已结合抗体的PR3和MPO作为种植抗原,在原位形成免疫复合物,然后再吸引其他中性粒细胞。
⑤ANCA激活的单核细胞产生MCP-1和IL-8,这些趋化物质的释放可扩大单核细胞和中性粒细胞募集的程度,可能导致肉芽肿形成。
2.感染 感染因素也可能导致WG:
(1)很多WG病人的初始症状与感染性疾病相似,病人常常因为呼吸道症状就诊。
(2)在WG病人中进行的支气管肺泡灌洗显示,病人通常表现为中性粒细胞肺泡炎。
(3)已知有几种感染与某些类型的血管炎相关。在人类,血管炎的发生与乙型肝炎、
丙型肝炎、Epstein-Barr病毒、parvo-B19和HIV感染相关。然而仅有不足1%的感染患者发生血管炎,提示宿主的特征决定了疾病的表达。
(4)Subra报告两例患亚急性心内膜炎的病人,C-ANCA均阳性。一例病人经抗生素治疗降低了C-ANCA的效价。另一例病人经抗生素和外科治疗使C-ANCA消失。但某些人认为,将持续感染作为血管炎的刺激剂的理论是站不住脚的:
①直到今天,气道活检标本的组织病理学研究(包括微生物的特殊染色和细菌、抗酸杆菌、真菌、支原体和呼吸道病毒的培养)都没有能够证实致病微生物的存在。
②在乙型肝炎、
丙型肝炎相关血管炎的病人中,应用免疫抑制治疗后,病情虽有显著改善,而他们携带的病毒却明显增加。
近年来,发现韦格纳肉芽肿病与两种特殊的微生物相关:微小病毒(parvovirus)B19和金黄色葡萄球菌。Stegeman发现鼻腔金黄色葡萄球菌的长期带菌与疾病的复发相关。金黄色葡萄球菌携带者复发率为无携带者的8倍。应用TMP/SMX后可降低缓解期病人上气道和鼻腔的复发。葡萄球菌产生的超抗原(SAg)可能是WG的一个重要的触发因子,SAg既可激发自身反应T细胞,也可激活自身反应性B细胞,参与血管炎的病理生理。Finkel在1例WG病人中,发现抗-B19,IgM反应持续近4年,应用巢式PCR证实为病毒血症,静脉注射免疫球蛋白,病人症状显著改善。
3.肉芽肿形成机制 在其他疾病中,肉芽肿通常是由致敏的CD4 T细胞(可产生Thl细胞因子)介导的。在WG中也出现相似的炎症,有一种假说认为,组织损伤和血管炎是否由畸变(不正常)的Thl免疫反应介导的。有几项研究支持这个假说:在WG和相关的血管炎中,细胞因子的产生有定性、定量的异常。在WG病人中,血清IL-1、IL-2、IL-6和TNF-α水平升高,循环单核细胞TNF-α的产生增加。应用反转录聚合酶联反应(RT-PCR)、原位杂交和免疫组化技术发现病人肾小球IL-1和TNF-α的产生增加。最近Ludviksson通过研究活动期WG病人的外周血淋巴细胞,发现与正常人相比,患者CD4 T细胞产生的IFN-γ水平高10~20倍,TNF-α的产生也有显著增加。相反,Th2细胞因子(IL-4、IL-5或IL-10)的水平无显著差异。 Ludviksson还观察到无论是活动期,还是缓解期,病人单核细胞IL-12的产生均增加,而IL-12为T细胞向Th1细胞(可产生IFN-γ)的基本诱导剂。
综上,当WG病人暴露于环境刺激(如感染)和(或)自体抗原诱导的过度巨噬细胞IL-12反应,引起Th1细胞因子(TNF-α、IFN-γ)产生增加,TNF-α、IFN-γ,可启动并维持肉芽肿性血管病变。此过程可被ANCA影响,ANCA可促进中性粒细胞、内皮细胞和单核细胞的激活。
 临床表现
临床表现
临床表现:依临床表现可分为3型:
1.经典型 表现为鼻窦炎、中耳炎,鼻炎伴鼻黏膜溃疡,咳嗽,
咯血和全身症状。
2.暴发型 表现为迅速的肾、呼吸功能衰竭。
多发于青壮年男性。最常侵犯的部位是副鼻窦、鼻咽腔、气管黏膜及肺间质,亦可侵及皮肤、眼、心等多系统多器官。以上、下呼吸道受累最多,并常与鼻咽部病变同发,如发热、清涕、咳嗽、
咯血、气短、胸闷等症状及肺内浸润性阴影等,鼻咽部症状如副鼻窦疼痛、鼻腔黏膜溃疡、鼻出血,至晚期鼻骨浸润形成鞍鼻等。
约50%患者出现皮肤血管炎表现,典型皮损为可触知的紫癜,对称分布于面部和四肢,特别是肘、膝和臀部,常出现坏死性丘疹、水疱、血疱等,偶可发生风团、红斑。下肢远端较为明显,也可发生于其他骨骼突出部位。随病情进展出现皮下结节,呈肉红色或紫色,质硬,有轻度触痛,严重者可有中央破溃、坏死。甚或出现更严重的坏疽型损伤。急性暴发型患者可有雷诺征,指端局部缺血或坏死,舌网状青斑。
肾脏病变出现在病程中晚期,如未能进行有效治疗可引致肾功能衰竭,是重要死因之一。眼部病变可有结膜炎、
泪腺炎、巩膜炎、虹膜炎、
视网膜血管炎、眼球突出、视力障碍等。
此外,约90%病人有游移性膝、踝等大关节疼痛或关节炎,但一般不引致关节畸形。约60%病人有中耳炎。约20%有神经系统受累,以单发或多发神经炎多见。约12%病人有心脏受累、出现冠状动脉炎等。长期鼻部携带金黄色葡萄球菌可增加疾病复发的危险。
 鉴别诊断
鉴别诊断
鉴别诊断:必须注意与其他具有肉芽肿性炎症、血管炎疾病相鉴别。
1.肺出血-肾炎综合征 病理学检查示体内存在抗肾小球基底膜抗体及荧光抗体检查有线状排列的IgG,这与韦格纳肉芽肿不同。
2.淋巴瘤样肉芽肿 除无上呼吸道受累外,尚有肾穿刺活检示肾小球淋巴样浸润,这些都可与本病鉴别。
3.特发性中线肉芽肿 是一种面部和上呼吸道局部破坏疾病,通过肾脏穿刺活检可与本病鉴别。
4.其他韦格纳肉芽肿 伴有
嗜酸粒细胞增多症时,还应注意与引起嗜酸粒细胞增多的许多原发病相鉴别,尤其应与过敏性肉芽肿相鉴别,后者以发热、发作性哮喘、嗜酸粒细胞增多为特征,其组织病理改变主要为嗜酸粒细胞浸润,病灶周围类上皮细胞呈放射状排列,受累的血管为中、小动脉,微动脉,静脉与毛细血管,无副鼻窦炎的临床表现和X线特征。另外,韦格纳肉芽肿的肺部症状及X线特征也与过敏性肉芽肿有显著不同。
 治疗
治疗
治疗:尚无特殊疗法。主要是早期发现和治疗。
1.内用治疗
(1)皮质类固醇激素:为治疗本病的首选药物,常用量为泼尼松1.0mg/(kg·d),分次口服。待病情稳定后逐渐减量至停药。为了增强疗效和减少其副作用,常与环磷酰胺联合用药。
(2)免疫抑制剂:首选环磷酰胺,常与泼尼松联合应用,是对活动性Wegener肉芽肿的最好的药物治疗方案。可使90%患者症状得到缓解。常用量为1~2mg/(kg·d),分2~3次口服,如为暴发性,可增至4mg/(kg·d),或静脉用药,一般用至疾病活动消退后继续维持6个月到1年。用药时应注意监测血象,使白细胞计数维持在3×109/L以上。也可选用硫唑嘌呤。新近有报道每周低剂量甲氨蝶呤(15~25mg)口服或肌内注射治疗,取得较好疗效。
(3)抗生素:有继发感染者应选择适当抗生素。
2.局部治疗 可据皮损性质和类型选用适当外用药物。
3.其他治疗 局部损害可用放射治疗、氩激光治疗等。必要时可行肾移植术。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
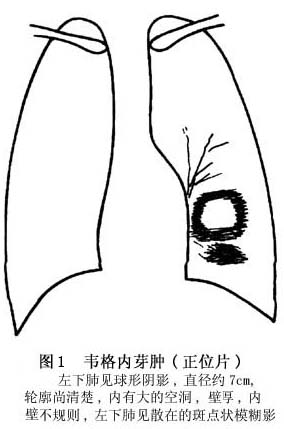
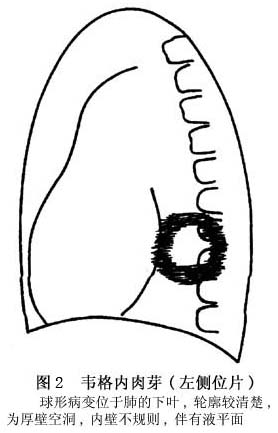
 诊断
诊断

 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防